আপুনি যদি অসমীয়া মাধ্যমৰ SEBA Class 9 ৰ ছাত্র বা ছাত্রী হয় তেন্তে নিচ্ছই আপুনি ইন্টাৰনেটত Class 9 Science Chapter 4 পৰমাণুৰ গঠন, Notes বা সহায়ক বিচাৰি আছে? হয়। চিন্তাৰ কোনো কাৰণ নাই, আমাৰ এই প্রবন্ধত অসমীয়া মাধ্যমৰ নৱম শ্ৰেণী সম্পূৰ্ণ সমাধান বিনামূলীয়া কৈ যোগান ধৰা হৈছে।
👉 Read Also:
নৱম শ্ৰেণীৰ Class 9 Science Chapter 4 পৰমাণুৰ গঠন
অধ্যায়-4
পৰমাণুৰ গঠন
পাঠৰ মাজত থকা প্রশ্নসমূহৰ উত্তৰ
(1)
1. কেনেল ৰশ্মি কি?
উত্তৰঃ কেনেল ৰশ্মি হ’ল তেজষ্ক্রিয় ধনাত্মক আধানেৰে গঠিত ৰশ্মি যিয়ে কেথডৰ ছিদ্ৰৰ মাজেৰে পাৰ হৈ যায়। এই ৰশ্মি ধনাত্মক আধানযুক্ত
প্ৰ’টনৰ দ্বাৰা গঠিত।
2. পৰমাণু এটাত থকা প্ৰ’টন আৰু এটা ইলেক্ট্রন থাকিলে ই কোনো আধান বহন কৰিবনে নকৰে?
উত্তৰঃ এটা ইলেক্ট্রন ঋনাত্মকভাবে আহিত আৰু এটা প্র’টন ধনাত্মকভাবে আহিত। গতিকে সিহঁতে বহন কৰা আধানৰ পৰিমাণ সমান। সেইবাবে এটা পৰমাণুত থকা প্ৰ’টন আৰু ইলেক্ট্র’নে কোনো ধৰণৰ আধান বহন নকৰিব।
পাঠৰ মাজত থকা প্ৰশ্নসমূহৰ উত্তৰ
(2)
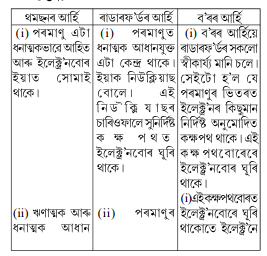
1. থমছনৰ পৰমাণুৰ আৰ্হিৰ মতে পৰমাণু এটা সামগ্রিকভাবে কেনেদৰে প্ৰশম হয় ব্যাখ্যা কৰা।
উত্তৰঃ থমছনৰ পৰমাণুৰ আৰ্হিৰ মতে এটা পৰমাণুৰ ধনাত্মক আৰু ঋণাত্মক আধান সমান মানৰ। সেইবাবে পৰমাণু এটা বৈদ্যুতিকভাবে প্রশম হয়।
2. ৰাডাৰফ’ৰ্ডৰ পৰমাণুৰ আৰ্হিৰমতে পৰমাণুৰ নিউক্লিয়াছত কোনটো উপ-পাৰমাণৱিক কণা থাকে?
উত্তৰঃ প্ৰ’টিন (proton)।
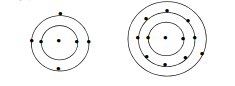
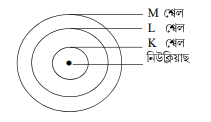
3. তিনিটা শ্বেলৰে সৈতে ব’ৰৰ পৰমাণুৰ আৰ্হিৰ এটা চিত্র অংকণ কৰা।
উত্তৰঃ
4. যদি ৫-কণা বিচ্ছুৰণ পৰীক্ষাটোত সোণৰ পাতৰ সলনি আন ধাতুৰ পাত ব্যৱহাৰ কৰা হয় তেনেহ’লে কি দেখা যাব বুলি ভাবা?
উত্তৰঃ সোণৰ পাতৰ সলনি আন ধাতু ব্যৱহাৰ কৰিলে প্রায় একে ফল পোৱা যার। কিন্তু, সকলো ধাতুরে ঘাতসহনশীল নহয় যাৰ বাবে অতি পাতল পাতলৈ ৰূপান্তৰ কৰিব নোৱাৰি। অতি পাতল পাতৰ মাজেৰেহে কণা সহজে বিচ্ছুৰণ কৰিব পাৰি।
পাঠৰ মাজত থকা প্রশ্নসমূহৰ উত্তৰ
(3)
1. পৰমাণুৰ তিনিটা উপ-পাৰমাণবিক কণাৰ নাম লিখা।
উত্তৰঃ পৰমাণুৰ তিনিটা উপ-পাৰমাণবিক কণাৰ নাম হ’ল- নিউট্রন, প্র’টন আৰু ইলেক্ট্রন।
2. হিলিয়াম পৰমাণুৰ পাৰমাণৱিক ভৰ 411 আৰু ইয়াৰ নিউক্লিয়াছত দুটা প্র’টন আছে। ইয়াত কিমানটা নিউট্রন থাকিব?
উত্তৰঃ পৰমাণু এটাৰ ভৰ পৰমাণুটোত থকা প্ৰ’টন আৰু নিউট্ৰনৰ ভৰৰ সমান আৰু পৰমাণুত প্র’টন আৰু নিউট্রন সংখ্যা সমান সমান থাকে। যিহেতু প্র’টন দুটা আছে। গতিকে, নিউট্রনো দুটা থাকিব।
পাঠৰ মাজত থকা প্রশ্নসমূহৰ উত্তৰ
(4)
1. কার্বন আৰু ছ’ডিয়াম পৰমাণুত ইলেক্ট্রনৰ বিতৰণ দেখুওৱা।
উত্তৰঃ
কাৰ্বন পৰমাণু ছ’ডিয়াম পৰমাণু
2. পৰমাণু এটাৰ K আৰু L শ্বেলবোৰ পূৰ্ণ হৈ থাকিলে পৰমাণুটোত ইলেক্ট্র’নৰ মুঠ সংখ্যা কিমান হ’ব?
পাঠৰ মাজত থকা প্রশ্নসমূহৰ উত্তৰ
(4)
1. ক্ল’ৰিণ, ছালফাৰ আৰু মেগনেছিয়ামৰ যোজ্যতা কেনেদৰে পাবা?
উত্তৰঃ পৰমাণু এটাৰ বহিঃকক্ষত থকা ইলেক্ট্রনক যোজ্যতা ইলেক্ট্রন বোলে। পৰমাণুটোৰ বহিঃকক্ষত 1 টা, 2 টা বা 3 টাকৈ ইলেক্ট্রন থাকিলে পৰমাণুটোৱে ইলেক্ট্রন এৰি দিব আৰু 5 টা, 6 টা বা 7 টাকৈ ইলেক্ট্রন থাকিলে ই ইয়াৰ বহিঃকক্ষত সাতটা ইলেক্ট্রন সম্পূর্ণ কৰিবলৈ ইলেক্ট্রন গ্রহণ কৰিব। গতিকে, পৰমাণুটোৱে এৰি দিয়া বা গ্রহণ কৰা ইলেক্ট্রনবোৰেই হ’ল যোজ্যতা ইলেক্ট্রন।
ক্ল’ৰিণৰ যোজ্যতা-2.8.7
ছালফাৰৰ যোজ্যতা-2.8.6
মেগনেছিয়ামৰ যোজ্যতা-2.8.2
ক্ল’ৰিণৰ যোজ্যতা ইলেক্ট্রন হ’ল = 8-7=1
ছালফাৰৰ যোজ্যতা ইলেক্ট্রন হ’ল86-2
মেগনেছিয়ামৰ যোজ্যতা ইলেক্ট্রন হ’ল 8-6-2
পাঠৰ মাজত থকা প্রশ্নসমূহৰ উত্তৰ
(5)
1. যদি পৰমাণু এটাত ইলেক্ট্র’নৰ সংখ্যা ৪ আৰু প্ৰ’টনৰ সংখ্যাও ৪ হয় তেন্তে
(i) পৰমাণুটোৰ পাৰমাণৱিক সংখ্যা কি হ’ব? আৰু
(ii) পৰমাণুটোৰ আধান কিমান হ’ব?
উত্তৰঃ (i) পৰমাণু এটাত থকা প্ৰ’টনৰ সংখ্যাই হ’ল পাৰমাণৱিক সংখ্যা। যিহেতু পৰমাণুটোত ৪ টা প্ৰ’টিন আছে, গতিকে ইয়াৰ পৰামাণবিক সংখ্যা হ’ব ৪।
(ii) যিহেতু পৰমাণুটোত ইলেক্ট্রন আৰু প্ৰ’টনৰ সংখ্যা সমান গতিকে, পৰমাণুটোৰ আধান শূণ্য হ’ব।
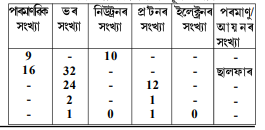
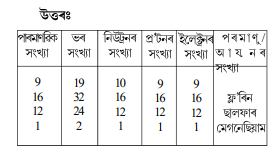
2. তালিকা 4.1 ৰ সহায়ত অক্সিজেন আৰু ছালফাৰৰ পৰমাণুৰ ভৰ সংখ্যা উলিওৱা।
পাঠৰ মাজত থকা প্রশ্নসমূহৰ উত্তৰ
(6)
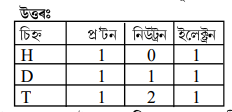
1. চিহ্ন H, D আৰু T প্রতিটোতে পোৱা উপ-পাৰমাণবিক কণাবোৰ তালিকাভূক্ত কৰা।
2. একোযোৰকৈ সমস্থানিক আৰু সমভাৰীৰ ইলেক্ট্রনীয় বিন্যাস লিখা।
 অনুশীলনীৰ প্রশ্নোত্তৰ
অনুশীলনীৰ প্রশ্নোত্তৰ
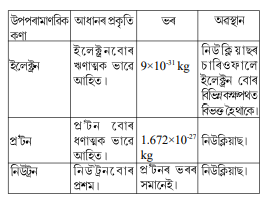
1. ইলেক্ট্রন, প্র’টন আৰু নিউট্রনৰ ধৰ্মসমূহ তুলনা কৰা।
উত্তৰঃ
2. জে জে থমছনৰ পৰমাণুৰ আৰ্হিৰ সীমাবদ্ধতাসমূহ কি কি?
উত্তৰঃ থমছনৰ আহিয়ে পৰমাণুবোৰ বৈদ্যুতিকভাবে যে প্রশম তাক প্ৰমাণ কৰিব পাৰিছিল যদিও ৰাডাৰফৰ্ডৰ আৰ্হিৰ দৰে ফলাফল পোৱা নাযায়। থমছনৰ আৰ্হিৰ কোনো ধৰণৰ প্ৰমাণিক ৰূপ পোৱা নাযায়।
3. ৰাডাৰফ’ৰ্ডৰ পৰমাণুৰ আৰ্হিৰ সীমাবদ্ধতাসমূহ কি কি?
উত্তৰঃ ৰাডাৰফ’ৰ্ডৰ পৰমাণু আৰ্হিৰ সীমাবদ্ধতাসমূহ হ’ল-
ৰাডাৰফ’ৰ্ডৰ আৰ্হিৰ পৰা বৃত্তকাৰ কক্ষপথত ইলেক্ট্রনৰ পৰিভ্ৰমণ সুস্থিৰ হোৱা আশা কৰা নাযায়। এই আর্হিমতে, বৃত্তকাৰ কক্ষপথত যিকোনো কণাৰ ত্বৰণ ঘটে আৰু ত্বৰণৰ সময়ত আধানযুক্ত কণাই শক্তি বিকিৰণ কৰে। যাৰ ফলত ইলেক্ট্রনেশক্তি হেৰুৱাব আৰু নিউক্লিয়াছত পতিত হ’ব। এইটো হোৱা হ’লে পৰমাণু অতিশয় অশান্ত হ’লহেতেন আৰু পদার্থক আমি দেখা ৰূপত পোৱা নগ’লহেতেন। আমি জানো যে পৰমাণুসমূহ সুস্থিৰ।
4. ব’ৰৰ পৰমাণু আৰ্হিটো বৰ্ণনা কৰা।
উত্তৰঃ ব’ৰৰ পৰমাণুৰ আৰ্হিটোৰ স্বীকাৰ্য্যসমূহ হ’ল-
(i) পৰমাণুৰ ভিতৰত ইলেক্ট্রনৰ কিছুমান নির্দিষ্ট অনুমোদিত কক্ষপথ থাকে।
(ii) এই কক্ষপথবোৰত ঘূৰি থাকোতে ইলেক্ট্রনে শক্তি বিকিৰণ কৰে।
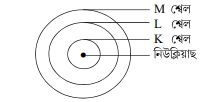
ব’ৰৰ আৰ্হিৰ কক্ষপথবোৰ বা শেলবোৰক শক্তিস্তৰ বোলা হয়। এই শক্তিস্তৰবোৰ K, L, M,N,……….. আখৰেৰে বুজোৱা হয় বা n = 1 2,3,………… সংখ্যাৰে বুজোৱা হয়।
5. এই অধ্যায়ত দিয়া পৰমাণুৰ আৰ্হিকেইটা তুলনা কৰা।
উত্তৰঃ
6. প্রথম ওঠৰটা মৌলৰ কাৰণে বিভিন্ন শ্বেলত ইলেক্ট্র’ন বণ্টনৰ নিয়মবোৰ সংক্ষেপে লিখা।
7. ছিলিকন আৰু অক্সিজেনক উদাহৰণ হিচাপে লৈ যোজ্যতাৰ সংজ্ঞা দিয়া।
উত্তৰঃ পৰমাণু এটাত থকা মুঠ ইলেক্ট্রনৰ সংখ্যাক যোজ্যতা আৰু বহিৰতম কক্ষত থকা ইলেক্ট্র’নবোৰক যোজ্যতা ইলেক্ট্র’ন বোলে।
ছিলিকনৰ ইলেক্ট্র’নীয় যোজ্যতা হ’ল 2.8.4 ইয়াৰ বহিঃকক্ষত থকা 4 টা ইলেক্ট্র’ন ভাগ-বতৰা হৈ সহযোজী বান্ধনি গঠন কৰি অষ্টফলকীয় নিয়ম সম্পূৰ্ণ কৰিব।
অক্সিজেনৰ ইলেক্ট্র’নীয় বিন্যাস হ’ল 2.6। ইয়াৰ বহিঃকক্ষত 6 টা ইলেক্ট্র’ন আছে। অষ্টফলকীয় নিয়ম সম্পূৰ্ণ কৰাৰ বাবে ই 2 টা ইলেক্ট্র’ন গ্রহণ কৰিব।
👉 Read Also:
৪. উদাহৰণেৰে সৈতে ব্যাখ্যা কৰা।
(i) পাৰমাণৱিক সংখ্যা
(ii) ভৰ সংখ্যা
(iii) সমস্থানিক আৰু
(iv) সমভাৰী।
সমস্থানিকৰ যিকোনো দুটা ব্যৱহাৰ লিখা।
9. Na+ত সম্পূর্ণরূপে পূৰ হৈ থকা K আৰু L শ্বেল আছে। ব্যাখ্যা কৰা।
উত্তৰঃ ছডিয়াম পৰমাণুৰ পাৰমাণবিক সংখ্যা 11। গতিকে, প্রশম ছ’ডিয়ামৰ ইলেক্ট্রনৰ সংখ্যা 11 আৰু যোজ্যতা 2.8.1। কিন্তু Na ইলেক্ট্রন সংখ্যা 10। গতিকে 10 টা ইলেক্ট্রন K আৰু L শ্বেলত ভগালে K শ্বেলত 2 টা আৰু L শ্বেলত ৪ টাকৈ ইলেক্ট্রন থাকিব। যিহেতু ব’ৰৰ তথ্য অনুসৰি Na এ ইলেক্ট্রনবোৰ K আৰু L শ্বেলত ভাগ বতৰা কৰি লৈছে।

12. যদি Z = 3 হয়, তেন্তে মৌলটোৰ যোজ্যতা কিমান হ’ব? মৌলটোৰ নাম লিখা।
উত্তৰঃ Z = 3 মানে হ’ল মৌলটোৰ পাৰমাণৱিক সংখ্যা 3। মৌলটোৰ ইলেক্ট্রনীয় বিন্যাস হ’ল 2.1। গতিকে মৌলটোৰ যোজ্যতা ইলেক্ট্রন 1। এতেকে Z = 3 থকা মৌলটো হ’ল লিথিয়াম।
14. তলৰ শুদ্ধ উক্তিবোৰৰ ঠাইত T আৰু ভুলবোৰৰ ঠাইত F লিখা।
(a) জে জে থমছনে প্রস্তাৱ কৰিছিল যে পৰমাণুৰ নিউক্লিয়াছত কেৱল নিউক্লিয়ন থাকে।
(b) ইলেক্ট্রন এটা আৰু প্ৰ’টন এটা লগ লাগি নিউট্রন এটা গঠন হয়। সেইবাবে ই প্রশম।
(c) ইলেক্ট্রন এটাৰ ভৰ প্ৰটনৰ ভৰৰ প্ৰায় গুণ।
(d) আয়ডিনৰ এটা সমস্থানিক টিংচাৰ আয়ডিন প্ৰস্তুত কৰাত ব্যৱহাৰ কৰা হয়, টিংচাৰ আয়ডিন মেডিচিন হিচাপে ব্যৱহাৰ কৰা হয়।
(a) F
(b) F
(c) T
(d) F
উত্তৰঃ (a) F
15. ৰাডাৰফ’ৰ্ডৰ আলফা কণা বিচ্ছুৰণ পৰীক্ষাই-
(a) পাৰমাণৱিক নিউক্লিয়াছ
(b) ইলেক্ট্রন
(c) প্রটন
(d) নিউট্রন আৱিষ্কাৰ কৰিছিল।
উত্তৰঃ (a) পাৰমাণৱিক নিউক্লিয়াছ।
16. মৌল এটাৰ সমস্থানিকবোৰৰ
(a) একে ভৌতিৰ ধৰ্ম
(b) ভিন্ন ৰাসায়নিক ধর্ম
(c) ভিন্ন সংখ্যক নিউট্রন
(d) ভিন্ন পাৰমাণৱিক সংখ্যা থাকে।
উত্তৰঃ (c) ভিন্ন সংখ্যক নিউট্রন।
17. Cl- আয়নত যোজ্যতা ইলেক্ট্রনৰ সংখ্যা
(a) 16
(b) 8
(c) 17
(d) 18
উত্তৰঃ (b) ৪
18. তলৰ কোনটো ছ’ডিয়ামৰ শুদ্ধ ইলেক্ট্রনীয় বিন্যাস?
(a) 2, 8
(b) 8, 2, 1
(c) 2, 1, 8
(d) 2, 8, 1
উত্তৰঃ (d) 2, 8, 1
19. তলৰ তালিকাখন সম্পূৰ্ণ কৰা।
অতিৰিক্ত প্রশ্নোত্তৰ
1. জে জে থমছনৰ পৰমাণু আৰ্হিৰ স্বীকার্য্যসমূহ কি কি আছিল?
উত্তৰঃ জে জে থমছনৰ পৰমাণু আৰ্হিৰ স্বীকার্য্যসমূহ হ’ল-
(i) পৰমাণু এটা ধনাত্মকভাবে আহিত একোটা গোলক আৰু ইলেক্ট্র’নবোৰ ইয়াত সোমাই থাকে।
(ii) ঋণাত্মক আৰু ধনাত্মক আধান সমান মানৰ। সেইবাবে পৰমাণু এটা বৈদ্যুতিকভারে প্রশম।
2. ৰাডাৰফ’ৰ্ডৰ ৫-কণা পৰ্য্যবেক্ষণবোৰ কি কি আছিল? পৰীক্ষাৰ
উত্তৰঃ ৰাডাৰফ’ৰ্ডৰ ৫-কণা পৰীক্ষাৰ পর্যবেক্ষণবোৰ আছিল এনে ধৰণৰ-
(i) সৰহভাগ তীব্রবেগী ৫-কণা সোণৰ পাতৰ মাজেৰে পোনে পোনে পাৰ হৈ গৈছিল।
(ii) কিছুমান ৫-কণা পাতখনৰ দ্বাৰা কিছু পৰিমাণে বিক্ষেপিত হৈছিল।
(iii) বিস্ময়কভাৱে প্রতি 12000 টা কণাত একোটাকৈ কণা প্রতিক্ষিপ্ত হোৱা দেখা গৈছিল।
3. ৫-কণা বিচ্ছুৰণ পৰীক্ষাটোৰ পৰা ৰাডাৰফ ৰ্ডৈ কি সিদ্ধান্ত গ্রহণ কৰিছিল?
উত্তৰঃ ৫-কণা বিচ্ছুৰণ পৰীক্ষাটোৰ পৰা ৰাডাৰফ’ৰ্ডে তলত দিয়া সিদ্ধান্তবোৰ গ্ৰহণ কৰিছিল-
(i) পৰমাণুৰ ভিতৰৰ সৰহভাগ ঠাইয়েই শূণ্য, কাৰণ সৰহভাগ ৫-কণা বিক্ষেপিত নোহোৱাকৈ সোণৰ পাতখনৰ মাজেদি পাৰ হৈ গৈছিল।
(ii) খুউব কম সংখ্যক কণা গতিপথৰ পৰা বিক্ষেপিত হৈছিল। ইয়াৰ পৰা বুজা যায় যে পৰমাণু এটাত ধনাত্মক আধানে নিচেই কম ঠাই অধিকাৰ কৰি থাকে।
(iii) a-কণাবোৰ নিচেই ক্ষুদ্র অংশ এটা 180° কোণত বিক্ষেপিত হৈছিল। ই সোণৰ পৰমাণু এটাৰ সমস্ত ধনাত্মক আধান আৰু ভৰ পৰমাণুটোৰ ভিতৰত নিচেই কম আয়নত কেন্দ্রীভূত হৈ থকাটো সূচাইছিল।
4. ৰাডাফ’ৰ্ডৰ নিউক্লীয় আৰ্হিৰ বৈশিষ্ট্যবোৰ কি কি আছিল?
উত্তৰঃ ৰাডাৰফ’ৰ্ডৰ নিউক্লীয় আৰ্হিৰ বৈশিষ্ট্যবোৰ আছিল-
(i) পৰমাণুত ধনাত্মক আধানযুক্ত এটা কেন্দ্র থাকে। ইয়াক নিউক্লিয়াছ বোলে। পৰমাণু এটাৰ প্ৰায় সকলোখিনি ভৰ নিউক্লিয়াছটোতেই ধূপ খাই থাকে।
(ii) নিউক্লিয়াছটোৰ চাৰিওফালে কিছুমান সুনির্দিষ্ট কক্ষপথত ইলেক্ট্র’নবোৰ ঘূৰি থাকে।
(iii) পৰমাণুৰ আকাৰৰ তুলনাত নিউক্লিয়াছৰ আকাৰ নিচেই সৰু।
5. ব’ৰৰ পৰমাণু আৰ্হিৰ স্বীকাৰ্য্যসমূহ কি কি?
উত্তৰঃ ব’ৰৰ পৰমাণু আৰ্হিৰ স্বীকাৰ্য্যসমূহ হ’ল-
(i) পৰমাণুৰ ভিতৰত ইলেক্ট্রনৰ কিছুমান নির্দিষ্ট অনুমোদিত কক্ষপথহে থাকে।
(ii) এই কক্ষপথবোৰত ঘূৰি থাকোতে ইলেক্ট্র’নে শক্তি বিকিৰণ নকৰে।
6. ব’ৰ আৰু বুৰিয়ে মৌল এটাৰ ইলেক্ট্র ‘নবোৰক বেলেগ বেলেগ শক্তিস্তৰ বা শ্বেলবোৰত কিদৰে বিভক্ত কৰিছিল? বর্ণনা কৰা।
উত্তৰঃ ব’ৰ আৰু বুৰিয়ে শক্তিস্তৰ বা শ্বেলবোৰত ইলেক্ট্র’নবোৰ ভাগ-বতৰা কৰিবলৈ তলত দিয়া নিয়ম ব্যৱহাৰ কৰিছিল-
(i) এটা শ্বেলত সর্ব্বোচ্চ 2n² টা ইলেক্ট্র’ন থাকিব পাৰে। n ক কক্ষপথ সংখ্যা বা শক্তিস্তৰ সূচক বোলে। য’ত n = 1, 2, 3,
গতিকে, প্রতিটো শ্বেলত থকা ইলেক্ট্র’নৰ সংখ্যা এনে ধৰণৰ হ’ব-
প্রথম কক্ষপথ বা K শ্বেলত= 2×1²=2
দ্বিতীয় কক্ষপথ বা L = 2ײ 2 = 8
তৃতীয় কক্ষপথ বা M শ্বেলত = 2×3² = 18
চতুর্থ কক্ষপথ বা N G|G = 2×4² = 32
এনেদৰে আন শ্বেলৰো ইলেক্ট্র’নৰ সংখ্যাবোৰ গণনা কৰিব পাৰি।
(ii) পৰমাণুৰ বহিৰতম কক্ষপথত সৰ্ব্বোচ্চ ৪ টা ইলেক্ট্র’ন থাকিব পাৰে।
(iii) ভিতৰৰ নিম্নতৰ শ্বেলবোৰ পূৰ্ণ নোহোৱা পর্যন্ত এটা নির্দিষ্ট শ্বেলত ইলেক্ট্র’ন সোমাব নোৱাৰে
7. যোজ্যতা ইলেক্ট্র’ন কাক বোলে?
উত্তৰঃ পৰমাণু এটাৰ বহিৰতম কক্ষ বা শ্বেলত থকা ইলেক্ট্র’নবোৰক যোজ্যতা ইলেক্ট্র’ন বোলে।
৪. পৰমাণু এটাৰ বহিৰতম শ্বেলত সর্ব্বোচ্চ কেইটাকৈ ইলেক্ট্রন থাকিব পাৰে?
উত্তৰঃ ৪ টা।
👉 Read Also: